NTRODUCCION:
El átomo es la expresión mas pequeña de la materia y a partir de ella se han logrado hacer diversas investigaciones y de esa manera se han hecho grandes descubrimientos acerca de este, utilizándolos se han logrado grandes avances en la ciencia y la tecnología.
En el desarrollo tecnológico la emisión electrónica de los átomos puede ser de verdadera utilidad como podremos comprobar a lo largo de este ensayo tiene muy diversas utilidades y, sabiendo utilizarlas correctamente podemos obtener diversos beneficios.
Para poder realizar estos adelantos fue necesario realizar las investigaciones adecuadas, por lo tanto hay que recordar que la base de todos estos fue planteada por científicos y posteriormente desarrollada en caso de no haber sido concluidos.
DESARROLLO:
El trazado isotópico en biología y en medicina.
Los diferentes isotopos de un elemento tienen las mismas propiedades químicas. El reemplazo de uno por otro en una molécula no modifica, por consiguiente, la función de la misma. Sin embargo, la radiación emitida permite detectarla, localizarla, seguir su movimiento e, incluso, dosificarla a distancia. El trazado isotópico ha permitido estudiar así, sin perturbarlo, el funcionamiento de todo lo que tiene vida, de la célula al organismo entero. En biología, numerosos adelantos realizados en el transcurso de la segunda mitad del siglo XX están vinculados a la utilización de la radioactividad: funcionamiento del genoma (soporte de la herencia), metabolismo de la célula, fotosíntesis, transmisión de mensajes químicos (hormonas, neurotransmisores) en el organismo.
unidad1
jueves, 13 de diciembre de 2012
Principios de Radiactividad
La radioactividad ha sido un término, que aun desconociéndose la naturaleza de su origen, en ocasiones, genera temor. Muchas de las veces, el temor que se ha generado sobre el uso de los materia radioactivos no es producto solo de la ignorancia que se tiene sobre los materiales, su definición, características de los materiales, control, entre otros, sino de los graves problemas a la salud y a la propia naturaleza que se han generado por el uso de materiales que tienen esta propiedad y de la grave forma en que se controlan estos materiales.
Es evidente en nuestra sociedad que los avances tecnológicos y científicos han marcado una nueva forma de vivir en sociedad. La salud humana no podría estar ajena a estos cambios, en el caso de las técnicas de medición y control utilizados mediante materiales radioactivos han permitido prolongar la vida y en algunas ocasiones no solo prolongar sino preservar, es tan así que se han abierto áreas como la radioterapia para tratar enfermedades como el cáncer o tumores.
INTRODUCCION
¿Qué es la radiactividad? La radiactividad o radioactividad es un fenómeno físico por el cual algunos cuerpos o elementos químicos, llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas fotográficas, ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria, entre otros.
Es evidente en nuestra sociedad que los avances tecnológicos y científicos han marcado una nueva forma de vivir en sociedad. La salud humana no podría estar ajena a estos cambios, en el caso de las técnicas de medición y control utilizados mediante materiales radioactivos han permitido prolongar la vida y en algunas ocasiones no solo prolongar sino preservar, es tan así que se han abierto áreas como la radioterapia para tratar enfermedades como el cáncer o tumores.
INTRODUCCION
¿Qué es la radiactividad? La radiactividad o radioactividad es un fenómeno físico por el cual algunos cuerpos o elementos químicos, llamados radiactivos, emiten radiaciones que tienen la propiedad de impresionar placas fotográficas, ionizar gases, producir fluorescencia, atravesar cuerpos opacos a la luz ordinaria, entre otros.
Configuracion electronica de los elementos y su ubicacion en la clasificacion periodica
Tabla periódica, configuración electrónica y propiedades periódicas
El Átomo
El primero en hablar sobre las partículas más diminutas que constituyen la materia, fue Demócrito (460 – 370 a.C.), luego de cientos de años, John Dalton retomó la idea del átomo, realizando una teoría la cual goza de aciertos y errores, pero siendo esta un gran adelanto. Posteriormente, Thompson, descubrió el electrón, Rutherford el protón y James Chadwick el neutrón.
El primero en hablar sobre las partículas más diminutas que constituyen la materia, fue Demócrito (460 – 370 a.C.), luego de cientos de años, John Dalton retomó la idea del átomo, realizando una teoría la cual goza de aciertos y errores, pero siendo esta un gran adelanto. Posteriormente, Thompson, descubrió el electrón, Rutherford el protón y James Chadwick el neutrón.
Estructura Básica del Átomo
El átomo, para Thompson consistía en un núcleo con los electrones insertados a su alrededor, tal como un budín de pasas. Para Rutherford, comprendía un sistema planetario con los electrones siguiendo orbitas alrededor del núcleo. Hoy en día, el átomo esta constituido principalmente por el núcleo, el cual posee protones (carga positiva) y neutrones (sin carga), alrededor de este núcleo se disponen los electrones (carga negativa) los cuales están moviéndose interminablemente y en forma caótica, generando una nube difusa.
El átomo, para Thompson consistía en un núcleo con los electrones insertados a su alrededor, tal como un budín de pasas. Para Rutherford, comprendía un sistema planetario con los electrones siguiendo orbitas alrededor del núcleo. Hoy en día, el átomo esta constituido principalmente por el núcleo, el cual posee protones (carga positiva) y neutrones (sin carga), alrededor de este núcleo se disponen los electrones (carga negativa) los cuales están moviéndose interminablemente y en forma caótica, generando una nube difusa.
Configuración Electrónica
Los cuatro números cuánticos (n, l, m, s) permiten identificar completamente un electrón en cualquier orbital de cualquier átomo. Si analizamos el átomo de hidrógeno, vemos que representa un sistema muy sencillo porque sólo contiene un electrón, que se ubica en el orbital “s” del primer nivel de energía. Esta situación es diferente para átomos que tienen más de un electrón. Para conocer la distribución de electrones en los distintos orbitales (lugares donde es más probable encontrar un electrón) en el interior de un átomo, se desarrolló la configuración electrónica. En ella se indica claramente el nivel de energía, los orbitales ocupados y el número de electrones de un átomo.
La configuración electrónica del átomo de hidrógeno es: 1s1
Para átomos más grandes, la configuración electrónica se efectúa según tres principios:
- Principio de mínima energía: Las configuraciones electrónicas de los elementos se obtienen por ocupación sucesiva de los niveles desde el primer nivel de menor energía (1s). A medida que los niveles se llenan, se van ocupando los niveles superiores. El orden de energía creciente puede ser recordado mediante el siguiente esquema:
Los cuatro números cuánticos (n, l, m, s) permiten identificar completamente un electrón en cualquier orbital de cualquier átomo. Si analizamos el átomo de hidrógeno, vemos que representa un sistema muy sencillo porque sólo contiene un electrón, que se ubica en el orbital “s” del primer nivel de energía. Esta situación es diferente para átomos que tienen más de un electrón. Para conocer la distribución de electrones en los distintos orbitales (lugares donde es más probable encontrar un electrón) en el interior de un átomo, se desarrolló la configuración electrónica. En ella se indica claramente el nivel de energía, los orbitales ocupados y el número de electrones de un átomo.
La configuración electrónica del átomo de hidrógeno es: 1s1
Para átomos más grandes, la configuración electrónica se efectúa según tres principios:
- Principio de mínima energía: Las configuraciones electrónicas de los elementos se obtienen por ocupación sucesiva de los niveles desde el primer nivel de menor energía (1s). A medida que los niveles se llenan, se van ocupando los niveles superiores. El orden de energía creciente puede ser recordado mediante el siguiente esquema:

Figura 1: Orden de llenado de los orbitales
- Principio de exclusión de Pauli: en cada orbital puede haber un máximo de dos electrones los cuales deben tener espín contrario.
- Por otra parte, los orbitales s, p, d y f pueden ser ocupados hasta por un total de
2, 6, 10 y 14 electrones respectivamente, pero cuando los subniveles están parcialmente llenos, los electrones se distribuyen de manera que presentan el máximo número de espines con el mismo valor o bien sus espines deben ser paralelos. Este es el Principio de máxima multiplicidad de Hund, que también puede enunciarse así: los electrones se distribuyen ocupando los orbitales disponibles en un solo sentido (spin) y luego con los que tienen espín opuesto, completando de esta manera el llenado orbital.
A modo de ejemplo, si queremos representar la configuración electrónica del átomo de nitrógeno, que tiene un total de siete electrones, se deben asignar dos electrones al subnivel “s” del nivel 1, esto es, 1s2, con lo que el nivel 1 queda completo. ¿Cómo se ubican los cinco electrones restantes?
Según el principio de exclusión de Pauli, cada orbital 2s, 2px, 2py, 2pz puede contener como máximo dos electrones de espín opuesto. Una vez que se ha llenado el orbital 2s se prosigue con los orbitales 2p, que poseen una energía ligeramente superior.
Para la siguiente figura: ¿Cuál de los ordenamientos corresponde al de menor energía para el átomo de N?
2, 6, 10 y 14 electrones respectivamente, pero cuando los subniveles están parcialmente llenos, los electrones se distribuyen de manera que presentan el máximo número de espines con el mismo valor o bien sus espines deben ser paralelos. Este es el Principio de máxima multiplicidad de Hund, que también puede enunciarse así: los electrones se distribuyen ocupando los orbitales disponibles en un solo sentido (spin) y luego con los que tienen espín opuesto, completando de esta manera el llenado orbital.
A modo de ejemplo, si queremos representar la configuración electrónica del átomo de nitrógeno, que tiene un total de siete electrones, se deben asignar dos electrones al subnivel “s” del nivel 1, esto es, 1s2, con lo que el nivel 1 queda completo. ¿Cómo se ubican los cinco electrones restantes?
Según el principio de exclusión de Pauli, cada orbital 2s, 2px, 2py, 2pz puede contener como máximo dos electrones de espín opuesto. Una vez que se ha llenado el orbital 2s se prosigue con los orbitales 2p, que poseen una energía ligeramente superior.
Para la siguiente figura: ¿Cuál de los ordenamientos corresponde al de menor energía para el átomo de N?

Principio de maxima multiplicidad de Hund
La regla de Hund es una regla empírica obtenida por Friedrich Hund en el estudio de los espectros atómicos que enuncia lo siguiente:
Al llenar orbitales de igual energía (los tres orbitales p, los cinco d, o los siete f) los electrones se distribuyen, siempre que sea posible, con sus espines paralelos, es decir, que no se cruzan. La partícula subatomica es más estable (tiene menos energía) cuando tiene electrones desapareados (espines paralelos) que cuando esos electrones están apareados (espines opuestos o antiparalelos).
También se denomina así a la regla de máxima multiplicidad de Hund:
Cuando varios electrones están descritos por orbitales degenerados, la mayor estabilidad energética es aquella en donde los espines electrónicos están desapareados (correlación de espines).
Para entender la regla de Hund, hay que saber que todos los orbitales en una subcapa deben estar ocupados por lo menos por un electrón antes de que se le asigne un segundo. Es decir, todos los orbitales deben estar llenos y todos los electrones en paralelo antes de que un orbital gane un segundo electrón. Y cuando un orbital gana un segundo electrón, éste deberá estar apareado del primero (espines opuestos o antiparalelos). Por ejemplo:
3 electrones en el orbital 2p; px1 py1 pz1 (vs) px2 py1 pz0
(px2 py1 pz0 = px0 py1 pz2 = px1 py0 pz2= px2 py0 pz1=....)
Así, los electrones en un átomo son asignados progresivamente, usando una configuración ordenada con el fin de asumir las condiciones energéticas más estables. El principio de Aufbau explica las reglas para llenar orbitales de manera de no violar la Regla de Hund.
También se puede decir de otra forma :
Al existir orbitales equivalentes, primero se completa con electrones el máximo posible de los mismos y luego se emparejan.
Principio de exclusion de Pauli
El principio de exclusión de Pauli fue un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual) en el mismo sistema cuántico ligado.1 Formulado inicialmente como principio, posterioremente se comprobó que era derivable de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin
Introducción
El principio de exclusión de Pauli sólo es aplicable a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. Son fermiones, por ejemplo, los electrones y los quarks (estos últimos son los que forman los protones y los neutrones). El principio de exclusión de Pauli rige, así pues, muchas de las características distintivas de la materia. En cambio, partículas como el fotón y el (hipotético) gravitón no obedecen a este principio, ya que son bosones, esto es, forman estados cuánticos simétricos y tienen espín entero. Como consecuencia, una multitud de fotones puede estar en un mismo estado cuántico de partícula, como en los láseres.
Es sencillo derivar el principio de Pauli, basándonos en el teorema espín-estadística aplicado a partículas idénticas. Los fermiones de la misma especie forman sistemas con estados totalmente antisimétricos, lo que para el caso de dos partículas significa que:
(La permutación de una partícula por otra invierte el signo de la función que describe al sistema). Si las dos partículas ocupan el mismo estado cuántico 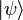 , el estado del sistema completo es
, el estado del sistema completo es  . Entonces,
. Entonces,
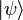 , el estado del sistema completo es
, el estado del sistema completo es  . Entonces,
. Entonces,
así que este caso no puede darse porque en ese caso el ket anterior no representa un estado físico. Este resultado puede generalizar por inducción al caso de más de dos partículas.
[editar]Consecuencias
El caso más conocido por su amplia utilización en el campo de la química y la física átomica es en el sistema cuántico del átomo de Schrödinger siendo los fermiones los electrones. Por ello es la versión más conocida de este lema: "Dos electrones en la corteza de un átomo no pueden tener al mismo tiempo los mismos números cuánticos". Esto explica que los electrones se distribuyan en capas alrededor de un núcleo y que por tanto los átomos con más electrones ocupen un tamaño mayor, además de que no sea posible interpenetrar de cierta manera las nubes electrónicas de los átomos, este hecho explica de hecho la impenetrabilidad de la materia ordinaria macroscópica.
Otro fenómeno físico del que es responsable el principio de Pauli es el ferromagnetismo, en el que el principio de exclusión implica una energía de intercambio que induce al alineamiento paralelo de electrones vecinos (que clásicamente se alinearían antiparalelamente).
Principio de Aufbau o de construccion
El principio de Aufbau contiene una serie de instrucciones relacionadas a la ubicación de electrones en los orbitales de unátomo. El modelo, formulado por el físico Niels Bohr, recibió el nombre de Aufbau (del alemán Aufbauprinzip: principio de construcción) en vez del nombre del científico. También se conoce popularmente con el nombre de regla del serrucho.
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos orientaciones del giro del electrón sin antes de que los restantes números cuánticos magnéticos de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía.
Primero debe llenarse el orbital 1s (hasta un máximo de dos electrones), esto de acuerdo con el número cuántico l.
Seguido se llena el orbital 2s (también con dos electrones como máximo).
La subcapa 2p tiene tres orbitales degenerados en energía denominados, según su posición tridimensional, 2px, 2py, 2pz. Así, los tres orbitales 2p puede llenarse hasta con seis electrones, dos en cada uno. De nuevo, de acuerdo con la regla de Hund, deben tener todos por lo menos un electrón antes de que alguno llegue a tener dos.
Y así, sucesivamente:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
El principio de exclusión de Pauli nos advierte, además, que ningún electrón en un átomo puede tener la misma combinación de números cuánticos como descripción de su estado energético con macromoleculas de hidrógeno, sin embargo se planteó que el átomo era una partícula que no existió.
[editar]Regla del serrucho o de las diagonales
Para llenar los orbitales correctamente, siga la dirección de la flecha tal como se muestra en la gráfica. Primero 1s, luego 2s, después sube a 2p y baja 3s, 3p y baja a 4s. En este punto, el siguiente nivel de energía más bajo no es 4p, sino que sube a 3d para luego bajar a 4p y 5s. Y así, sucesivamente.
Se le llama la regla del serrucho, debido a la acción de subir y bajar del modo descrito:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p... REGLA SERRUCHO o REGLA DIAGONAL

Distribucion electronica en sistemas polielectronicos
Primero que nada es necesario que te familiarices con la tabla periódica y el por qué los elementos están acomodados en esa forma. La tabla periódica "oficial" de curso es la de Web Elements, ya que está actualizada y además nos da solo la información que necesitamos.
Baja tu tabla de aquí.
Como puedes ver la tabla periódica tiene 7 filas en su estructura principal, éstas corresponden con los 7 niveles de energía en que puede estar un electrón. Es decir, la fila en que se encuentra un elemento dentro de la tabla periódica es un indicativo de los niveles de energía que posee y esto nos será muy útil para encontrar su configuración electrónica.
Además de eso, la tabla periódica contiene 18 columnas, estas columnas corresponden con los subniveles en que se encuentran los electrones de valencia de los elementos, las columnas 8 columnas más altas son llamadasgrupos A y el número de grupo nos dice exactamente el número de electrones de valencia de elemento. Además, los elementos de los grupos A, tienen sus electrones de valencia en el subnivel s (grupos AI y AII) y en elsubnivel b (grupos AIII a AVIII). Las columnas centrales que están un poco más bajas son llamadas grupos B corresponden a los metales de transición y nos indican que estos tienen sus electrones de valencia en el subnivel d, dependiendo de en qué columna estén es el número de electrones que se encuentran en ese subnivel.
En la parte baja de la tabla periódica observamos dos filas que tienen 14 columnas cada una. Estos elementos tienen sus electrones de valencia en elsubnivel f y se les conoce como tierras raras.
Para escribir la configuración electrónica de un elemento seguimos dos principios básicos:
Principio de construcción (Aufbau)
Los electrones van llenando los orbitales según el siguiente diagrama.

Para el llenado de orbitales se sigue el principio de Hund, que dice que para poder comenzar a aparear los electrones debe haber un electrón en cada uno de los orbitales del subnivel.
Suscribirse a:
Entradas (Atom)